现在的位置:主页 > 综合新闻 >
JMC | PROTAC技术在药物发现中的优势与挑战
【作者】网站采编【关键词】【摘要】原创 叨叨一下 唯信计算 前天 引言 近年来,靶向蛋白降解嵌合体 (PROTAC)作为新颖的诱导蛋白降解方式已成为一种全新的药物发现策略。来自英国人工智能公司BenevolentAI的Ian Churcher从药
原创 叨叨一下 唯信计算 前天
引言
近年来,靶向蛋白降解嵌合体 (PROTAC)作为新颖的诱导蛋白降解方式已成为一种全新的药物发现策略。来自英国人工智能公司BenevolentAI的Ian Churcher从药物发现的角度对PROTAC历史、技术的独特优势和面临的挑战进行了综述。

传统药物发现策略的局限性
传统药物设计常常专注于优化药物结合亲和力,但往往限制了更多高效药物的发现,因为识别一种高效能和高选择性的药物来调节一个生物靶点并不总是那么简单,面对越来越多缺乏高亲和力配体结合位点的药物干预靶点的发现,传统的小分子成药技术显得无计可施。
越来越多的方法被用来规避这些限制,单克隆抗体和其他蛋白制剂虽然具有高亲和力和选择性的优势,但这些制剂目前只能应用于细胞外或细胞表面靶点,而大多数基因组蛋白质和当代药物靶点是在细胞内发挥作用。通过基因沉默或RNA抑制剂作用于靶点,虽然在临床前是非常有效的,但必需的寡核苷酸制剂本身也存在着多项挑战(细胞传递、稳定性、生物分布、选择性等),必须克服这些挑战才能开发出成功的药物。
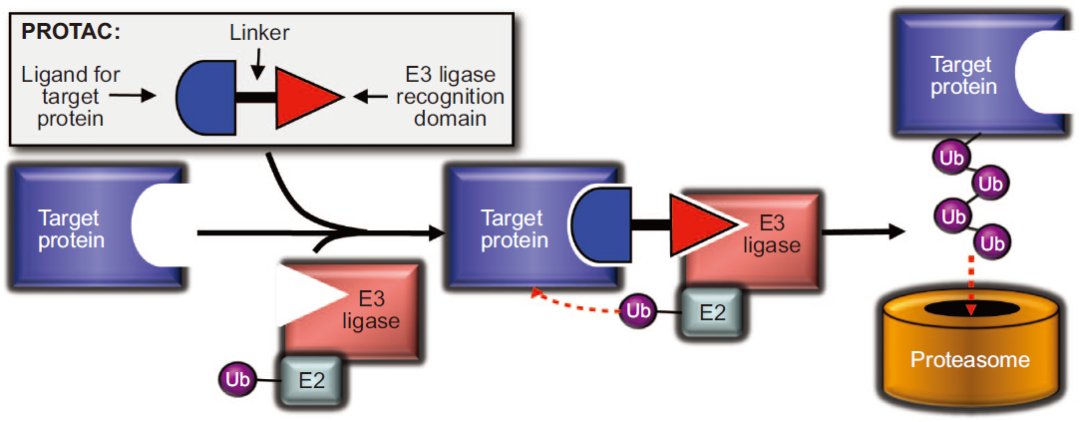
图1. PROTAC诱导蛋白降解的作用机制
图片来源:ACS Chemical Biology
靶向蛋白降解嵌合体 (PROTAC)技术简介
靶向蛋白降解嵌合体 (PROTAC)不同于传统的小分子抑制剂,PROTAC采用的是事件驱动(event-driven)的药理学作用模式,而非传统的小分子占据驱动模式(occupancy-driven)。PROTAC诱导蛋白降解的作用机制见图1,PROTAC分子包括三部分,一头是靶向目的蛋白结构,另一头招募泛素E3连接酶,中间通过合适的连接体(linker)连接,通过连接体将靶蛋白配体与泛素E3连接酶配体连接一起,在体内分别识别靶蛋白和泛素E3连接酶,通过诱导招募泛素E3连接酶至靶蛋白表面,引发多聚泛素化过程诱导靶蛋白降解,从而达到疾病治疗的效果。这种全新的小分子诱导药理学的途径对药物发现过程产生了深远影响。
借用自然:PROTAC技术的起源
自然界已经发展出一系列的生物途径,通过精准的信号增强和衰减以及其他过程来维持生物内环境的稳定和细胞对刺激的反应。这些途径只有一小部分步骤使用直接的小分子调节器(如激素和其他GPCR配体、突触信号、代谢物传感和调节),大多数调节是通过复杂的途径进行的,最终导致蛋白质合成或转换。随着我们对细胞内源性蛋白质降解机制的理解越来越清楚,潜在的治疗策略也开始出现。细胞内蛋白质的降解主要有两种途径,即泛素-蛋白酶体系统(UPS)和自噬/溶酶体途径。其中,泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与细胞内80%以上。以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose因共同发现了泛素调节的蛋白降解过程,获得了2004年的诺贝尔化学奖。PROTAC技术便是来源于这项诺贝尔奖,其在一定程度上利用细胞内的泛素-蛋白酶体系统来降解掉目的蛋白,PROTAC将靶点蛋白连接到泛素E3连接酶,招募E2连接酶给目标蛋白加上泛素标签,多聚泛素化之后的蛋白质被蛋白酶体识别并被蛋白质水解为氨基酸,PROTAC分子释放出来,继续进行重复的过程(图2)。

图2. 靶点蛋白水解过程
图片来源:Kymera Therapeutics
在设计PROTAC分子时,需要特别关注以下几点,PROTAC分子必须与靶点蛋白和泛素化机制结合,形成有效的三元复合物,才能实现靶蛋白降解。因此,首先要保障PROTAC能透过细胞膜成功的进入细胞;一旦进入细胞内,蛋白质降解分子必须同时与目标蛋白和泛素化机制结合,形成三元复合物,避免形成二元复合物“hook effect”;三元复合物一旦形成,泛素必须以足够的速率(快于三元复合物的本征寿命)转移到靶蛋白受体位点上(通常是表面赖氨酸),所需底物的诱导泛素化也应以这样的速率进行,以克服由二氢奎素酶竞争性去除泛素的情况;最后,泛素转移到底物蛋白上的模式应允许蛋白酶体容易识别,从而开始实际降解。
蛋白质可与多种泛素形成不同长度的链和不同赖氨酸残基(例如K6、K11、K27、K29、K33、K48、K63和M1)连接的拓扑结构。在生理学上,不同的多泛素连接和链长/拓扑结构可以导致在蛋白质功能精细调节的复杂系统中的一系列细胞反应。其中,K48连接泛素和其他的线性链被认为有利于蛋白酶体识别。另外,蛋白酶体起始区域部分无序loop或domain的存在也很重要,在某些情况下,如果该区域不存在,蛋白质虽然可以广泛多聚化,但不被蛋白酶体识别。
文章来源:《中国当代医药》 网址: http://www.zgddyyzz.cn/zonghexinwen/2020/1030/581.html
中国当代医药投稿 | 中国当代医药编辑部| 中国当代医药版面费 | 中国当代医药论文发表 | 中国当代医药最新目录
Copyright © 2018 《中国当代医药》杂志社 版权所有
投稿电话: 投稿邮箱:

